我院王洪辉副教授课题组近日在细胞调控领域取得重要进展。相关论文 “Near-Infrared Light-Activated DNA-Agonist Nanodevice for Nongenetically and Remotely Controlled Cellular Signaling and Behaviors in Live Animals” (DOI: 10.1021/acs.nanolett.9b00421)发表在国际顶尖学术期刊Nano Letters(影响因子12.08)上。该项研究是365英国上市公司在线与化学化工学院教师在前期工作基础(Angew. Chem. Int. Ed., 2018, 57, 10226, DOI: 10.1002/anie.201806155,影响因子12.102)上的又一项学科交叉课题的最新成果。
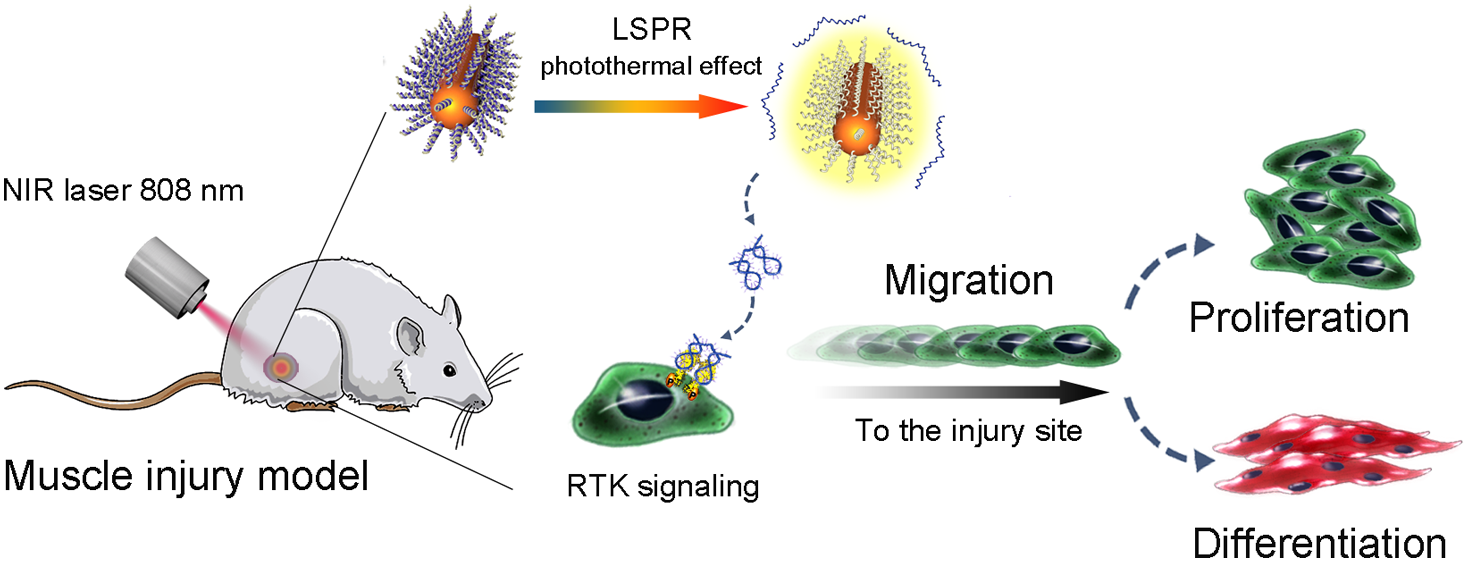
骨骼肌损伤愈合的过程包括肌肉卫星细胞的激活、定向迁移、分裂增殖形成新的肌管细胞,进而发育成肌纤维,在肌肉功能恢复中起关键作用。受体酪氨酸激酶(RTK)信号转导途径协调细胞增殖,分化和迁移等多种细胞功能。近年来,光遗传学的发展为精确控制受体介导的细胞行为提供了有强大的工具。然而,大多数基于光响应受体的操控需要对细胞进行遗传改造,且这些受体仅对紫外线或可见光响应,无法实现穿透厚组织的远程控制。因此,光遗传的方法难以在骨骼肌等深层组织修复的过程中实现对特定细胞的精准调控。
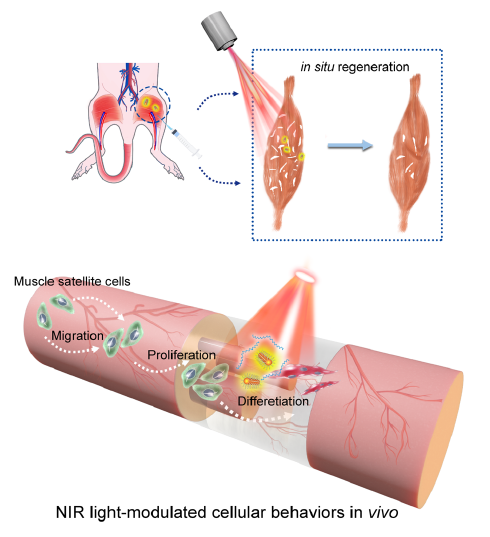
为了解决这一难题,王洪辉副教授和聂舟教授的课题组合作开发出一种近红外光激活DNA激动剂(NIR-DA)纳米装置,成功实现对活体深层组织内的细胞信号、表型和行为的精准调控。上述NIR-DA纳米装置是由基于核酸适配体构建的DNA激动剂与金纳米棒(AuNRs)组装制备而成。在近红外光作用下,AuNRs的局域表面发生等离子体共振(LSPR)光热效应,释放并激活DNA激动剂,再通过引发细胞表面RTK二聚激活细胞下游信号转导,从而改变细胞表型,控制细胞的行为。应用上述策略,研究小组实现了近红外光控制的细胞骨架重塑、细胞极化和定向迁移等行为。最后,该研究应用NIR-DA系统在小鼠体内实现了对RTK信号转导途径的光激活,引发骨骼肌组织内的卫星细胞发生迁移、增殖和分化,促进骨骼肌再生。因此,NIR-DA系统为再生医学治疗策略提供了一种可在活体深层组织实现外源调控的多功能平台。
365英国上市公司在线王洪辉副教授和化学化工学院聂舟教授为该研究论文的共同通讯作者,论文主要工作由硕士研究生王苗和贺芳协作完成,论文参与作者还包括加州大学圣地亚哥分校医学院PradiptaGhosh教授、博士后研究员李浩,以及张景慧和杨思慧等博士研究生。该研究获得了湖南省重点研发计划、国家自然科学基金杰出青年基金、面上项目等多个项目的支持。
供稿人:贺芳
文章链接:
https://pubs.acs.org.ccindex.cn/doi/10.1021/acs.nanolett.9b00421
