细胞膜张力由细胞黏附、骨架重排和细胞形变能力等多种作用共同决定,反映了细胞的力响应和力传递性能,是表征肿瘤细胞运动和转移能力的一个重要物理学参数(1-3)。膀胱癌发病于膀胱上皮,其肌层浸润和转移能力较强,并且长期受到肌肉收缩、流体冲击等生物力学作用,因此从细胞力学角度揭示膀胱癌转移特性具有重要意义(4),但是至今调控其细胞力学的分子机制尚未明确(5, 6)。2022年4月11日,365英国官网登录入口分子科学与生物医学实验室(MBL)的叶茂/谭蔚泓教授团队在《美国科学院院刊》(PNAS)杂志发表题为“Elucidation of CKAP4-remodeled cell mechanics in driving metastasis of bladder cancer through aptamer-based target discovery”的文章。该研究基于课题组在核酸适体研究领域的优势,利用特异性靶向膀胱癌细胞的核酸适体spl3c作为分子工具,发现在膀胱癌细胞中特异性高表达蛋白-CKAP4,明确其作为细胞膜张力调控关键因子,能重塑细胞膜中心-边缘的张力梯度,促进膀胱癌细胞的迁移。同时,还能“搭乘”外泌体实现细胞间的力学信号传递,从而加剧膀胱癌在体内的转移。

在该项研究中,研究人员以人膀胱癌细胞为正筛细胞,以人输尿管上皮永生化细胞为负筛细胞,基于cell-SELEX筛选技术,获得了一条能特异性靶向人膀胱癌细胞的核酸适体-spl3c,并通过pull-down实验和质谱分析,鉴定其结合的靶标蛋白为CKAP4。
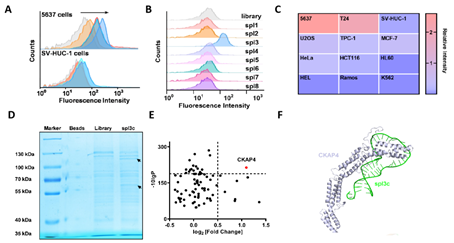
图1. 膀胱癌特异性核酸适体的筛选及靶标鉴定。A,流式细胞术监测筛选进程;B,核酸适体spl3的选取;C,核酸适体的细胞靶向性;D,核酸适体结合蛋白的凝胶电泳;E,核酸适体靶标CKAP4的鉴定;F,核酸适体与CKAP4结合的计算机模拟。
研究人员通过对数据库分析发现CKAP4在膀胱癌中显著高表达,并与膀胱癌的转移和不良预后显著相关。为进一步证实该作用,研究者通过原子力显微镜测定了细胞膜张力,发现CKAP4重塑了膀胱癌细胞膜表面中心-外围膜张力梯度,导致细胞的迁移能力增强,并在小鼠转移模型中促进膀胱癌细胞向肝和肺部的转移。有趣的是,CKAP4这一细胞力学调控因子还能够在外泌体中表达,并经外泌体途径实现细胞间力学信号的传递,从而进一步加剧膀胱癌的体内转移。
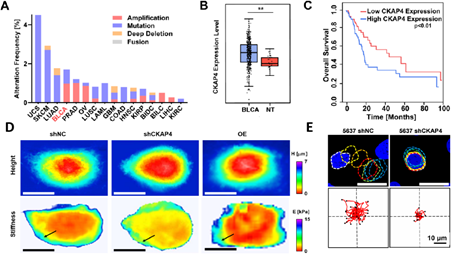
图2. CKAP4在膀胱癌中的作用。A,CKAP4在泛癌中的突变特征;B,CKAP4在膀胱癌中的表达情况;C,CKAP4表达对生存期的作用;D,CKAP4表达对细胞膜张力的作用;E,CKAP4表达对细胞运动的作用。
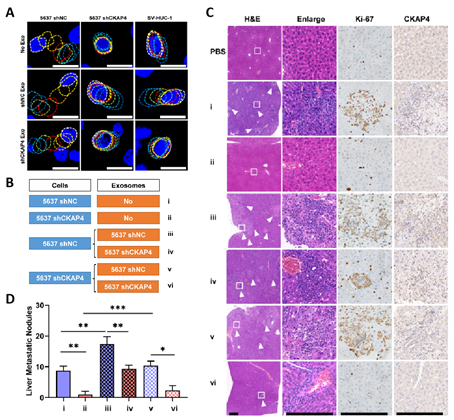
图3.外泌体CKAP4促进膀胱癌的体内转移。A,外泌体CKAP4对细胞迁移的作用;B,实验分组情况;C,外泌体CKAP4促进膀胱癌肝转移;D,外泌体CKAP4促进膀胱癌肝转移的统计分析。
综上所述,这项研究利用核酸适体作为分子工具,发现了细胞膜张力调控关键因子-CKAP4,明确了其不仅能重塑细胞膜表面张力,而且还能经外泌体实现细胞间力学信号的传递,从而增强膀胱癌细胞的迁移能力,促进其体内的转移。该项研究利用多学科交叉优势,开拓了膀胱癌力学研究的新方向,为膀胱癌的防治提供了新思路。
365英国官网登录入口分子科学与生物医学实验室(MBL)的叶茂和谭蔚泓教授为该论文的通讯作者,孙星为第一作者。谢琳、邱思源和荔辉为共同第一作者。
365英国官网登录入口叶茂/谭蔚泓教授团队实验室长期招收对肿瘤生物学和化学生物学研究方向感兴趣的研究生(推免生)以及博士后。欢迎联系:goldleaf@hnu.edu.cn (叶茂)或 tan@hnu.edu.cn (谭蔚泓)。
参考文献
1. N. C. Gauthier, M. A. Fardin, P. Roca-Cusachs, M. P. Sheetz, Temporary increase in plasma membrane tension coordinates the activation of exocytosis and contraction during cell spreading. Proc. Natl. Acad. Sci. U. S. A. 108, 14467-14472 (2011).
2. S. Massou et al., Cell stretching is amplified by active actin remodelling to deform and recruit proteins in mechanosensitive structures. Nat. Cell Biol. 22, 1011-1023 (2020).
3. Andrew R. Houk et al., Membrane Tension Maintains Cell Polarity by Confining Signals to the Leading Edge during Neutrophil Migration. Cell 148, 175-188 (2012).
4. J. M. Jaslove, C. M. Nelson, Smooth muscle: a stiff sculptor of epithelial shapes. Philos. Trans. R. Soc. Lond., Ser. B: Biol. Sci. 373, 1-12 (2018).
5. B. S. Adami et al., Morphological and mechanical changes induced by quercetin in human T24 bladder cancer cells. Micron 151, 103152 (2021).
6. M. Lekka, J. Pabijan, B. Orzechowska, Morphological and mechanical stability of bladder cancer cells in response to substrate rigidity. Biochimica et Biophysica Acta (BBA) - General Subjects 1863, 1006-1014 (2019).
